Artykuł został opublikowany w Przeglądzie Urologicznym 2021/4 (128)
Autorzy: Magdalena Zagrodzka, Marek Zawadzki, Przemysław Zugaj, Mateusz Mokrzyś, Damian Sujecki, Grzegorz Gacki, Marcin Radko, Wojciech Tur, Mieszko Kozikowski, Tomasz Piecha, Michał Pyzlak, Jacek Brzeziński, Patryk Sulmiński
W pracowni rezonansu magnetycznego Quadia wykonujemy rutynowo robotyczną biopsję gruczołu krokowego pod kontrolą rezonansu magnetycznego tzw. biopsję in-bore. Na całym świecie funkcjonuje około 30 ośrodków dysponujących robotem firmy Soteria umożliwiającym precyzyjne pobranie wycinka z podejrzanej zmiany. Tym co wyróżnia nasz ośrodek jest fakt, iż biopsję wykonuje nie tylko lekarz radiolog, lecz wielodyscyplinarny zespół składający się z lekarzy specjalistów radiologów, urologów, techników oraz pielęgniarek.
Poniższy artykuł ukazał się w Przeglądzie Urologicznym 2021/4 (128) i opisuje nasze praktyczne doświadczenia w wykonywaniu biopsji in-bore.
Z ukazujących się w światowym piśmiennictwie publikacji wynika, że biopsja in-bore (IB) wykonywana wewnątrz aparatu MR przewyższa biopsję fuzyjną (FB) pod względem wykrywalności klinicznie istotnego raka stercza i ma niższy odsetek stwierdzenia nieistotnego klinicznie raka stercza.
W poniższym materiale chcemy podzielić się doświadczeniami w wykonywaniu biopsji IB oraz przedstawić zalety tej metody diagnostycznej na przykładach klinicznych zbadanych w naszej pracowni pacjentów. Wszystkie biopsje IB wykonujemy w zespole interdyscyplinarnym, wspólnie z kolegami z wielu ośrodków urologicznych.
Sporą grupę wśród zbadanych pacjentów stanowią mężczyźni z negatywnymi wynikami biopsji fuzyjnych MR/USG. Niepodważalną zaletą biopsji IB jest możliwość pobierania wycinków wyłącznie z miejsc podejrzanych o obecność procesu nowotworowego, w oparciu o sekwencje DWI i obliczone na ich podstawie mapy ADC. Mówiąc w bardziej przystępny sposób, igła biopsyjna wprowadzana jest w obszar określony jako najbardziej podejrzany nie na podstawie obrazów anatomicznych (T2), ale na podstawie obrazów „czynnościowych” (DWI/ADC), wskazujących miejsca o najwyższym prawdopodobieństwie zajęcia procesem nowotworowym. Wymaga to perfekcyjnie wykonanego wysokiej jakości badania MR stercza oraz dużego doświadczenia całego zespołu. W naszej ocenie najlepsze efekty można osiągnąć łącząc w tym procesie diagnostycznym doświadczenie zarówno radiologów, jak i urologów. Poniżej przedstawiamy nasze doświadczenia dotyczące wykonywania biopsji IB.
Biopsja IB z perspektywy publikacji
Obecnie piśmiennictwo dotyczące biopsji in-bore nie jest obszerne, a to odnoszące się do biopsji robotycznych jeszcze mniejsze. Jednakże, opierając się nawet na kilku najważniejszych publikacjach poświęconych temu zagadnieniu, należy stwierdzić, że biopsja in-bore jest metodą bardzo obiecującą.
Cata i współautorzy w swoim zestawieniu porównawczym 37 prac dotyczących biopsji stercza stwierdzili, że chociaż biopsja IB i biopsja fuzyjna (FB) mają zbliżoną przewagę nad biopsją systemową (SB) zarówno w odniesieniu do wykrywalności całkowitej, jak i wykrywalności klinicznie istotnego raka stercza, to biopsja IB jest najskuteczniejszą z wyżej wymienionych metod jeśli chodzi o potwierdzenie obecności raka, zwłaszcza w przypadku zmian niewielkich rozmiarów oraz zmian zlokalizowanych w wierzchołku.
Villanova i współautorzy po wykonaniu biopsji IB u 30 pacjentów z pojedynczą zmianą PI-RADS≥3 ustalili, że:
––wykrywalność całkowita raka w tej grupie wyniosła 73% (22/30), 86% (19/22) dla raków istotnych klinicznie (Gl.s. >6 i zajęcie >3 mm wycinka);
––u pacjentów bez wcześniejszych biopsji wykrywalność wyniosła 89% (16/18) i 50% (6/12) u pacjentów po negatywnych wynikach biopsji TRUS;
––dla zmian PI-RADS >3 wykrywalność wyniosła 92% (22/24). Wszystkie wykryte zmiany były w zasięgu ramienia manipulatora robotycznego.
Perrin i współautorzy w oparciu o swoją retrospektywną analizę badań IB wykonanych pomiędzy marcem 2013 a październikiem 2017 roku w dwóch europejskich ośrodkach specjalizujących się w diagnostyce raka stercza (53 pacjentów wcześniej nieleczonych z powodu raka stercza, ze zmianami PI-RADS≥3 w mpMR, bez istotnego klinicznie raka stercza w FB, z wykonaną IB) zaobserwowali, że biopsja IB była w stanie wykryć raka stercza u 1 na 4 mężczyzn z negatywnym wynikiem wcześniej wykonanej FB.
Costa i współautorzy na podstawie porównania wyników badań biopsji IB 103 pacjentów oraz wyników badań biopsji FB 300 pacjentów ustalili, że biopsja IB pozwoliła wykryć klinicznie istotnego raka stercza u większego ich odsetka (61%, 63/103) niż FB (47%, 141/300).
Sugano i współautorzy na podstawie zestawienia porównawczego prac poświęconych diagnostyce raka stercza stwierdzili, że biopsja IB jest metodą dokładniejszą, bardziej precyzyjną, pozwalającą potwierdzić obecność raka przy mniejszej liczbie wycinków (w których na dodatek rak zajmuje większą objętość) niż biopsja kognitywna.
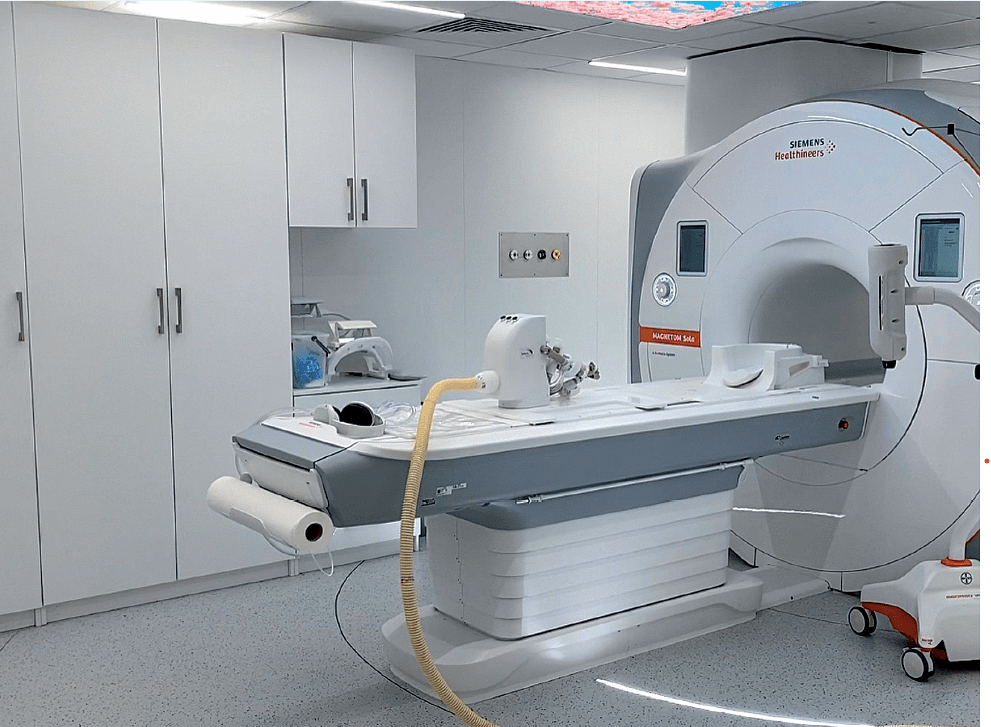
Ryc. 1. Robot do biopsji in-bore przygotowany do zabiegu w aparacie Magnetom Sola 1,5T XQ
Biopsja in-bore w naszej pracowni
Nasza pracownia ze względu na swój profil badań (80% stanowią pacjenci urologiczni, andrologiczni i onkologiczni) jest miejscem otwartym na współpracę z całym środowiskiem urologicznym. Decydując się na wykorzystanie robotycznej biopsji IB, od samego początku zaprosiliśmy do współpracy kolegów z wielu placówek urologicznych z całego Mazowsza. Obecnie zespół urologów wyszkolonych i wykonujących z nami robotyczne biopsje IB liczy 10 urologów z pięciu różnych ośrodków.
Dużym pozytywnym zaskoczeniem dla nas okazał się czas trwania całej procedury IB. W naszej placówce waha się on od 30 do maksymalnie 60 minut. Jest to możliwe właśnie dzięki temu, że biopsje wykonujemy wspólnie z urologami, dzieląc zadania i wymieniając się doświadczeniem z naszych dziedzin kompetencji.
Czy biopsja może być wykonana w każdym aparacie MR? W naszym odczuciu kluczowe dla skuteczności
biopsji IB jest to, żeby pacjent w jej trakcie nie poruszał się. Dlatego też istotny wpływ na jej przebieg ma komfort pacjenta, a zwłaszcza przestrzeń, jaką dysponuje on wewnątrz aparatu MR. Aparaty z tunelem o małej średnicy (60 cm) mogą ten komfort ograniczać. W trakcie biopsji IB pacjent jest ułożony w pozycji na brzuchu i musi pozostać w bezruchu podczas całej procedury. Dużo prościej jest zapewnić pacjentowi komfort, a co za tym idzie ograniczyć jego poruszanie się i w efekcie zwiększenie prawdopodobieństwa skuteczności biopsji IB, w aparatach z większą średnicą okola (ryc. 1).
W oparciu o wykonane dotychczas w naszej placówce biopsje IB zaobserwowaliśmy, że dla ich skuteczności kluczowe znaczenie ma przygotowanie pacjenta. Zarówno rozmowa, w trakcie której pacjent otrzymuje wszystkie potrzebne mu informacje o przebiegu biopsji IB od momentu wejścia do pracowni aż do chwili jej opuszczenia, jak i zapewnienie jak najbardziej komfortowej pozycji, aby wytrzymał w bezruchu przez cały czas jej trwania, mają istotne znaczenie dla efektu procedury. Szczegółowe omówienie z pacjentem przebiegu całej biopsji – od chwili umieszczenia w odbytnicy prowadnika igły biopsyjnej, poprzez hałas aparatu w trakcie uzyskiwania obrazów, aż do zmian pozycji manipulatora dostosowującego swoje położenie do obszaru, z którego ma być pobrany materiał – ma na celu takie przygotowanie pacjenta, aby żadna z wyżej wymienionych czynności nie była zaskoczeniem mogącym spowodować nagłą zmianą jego pozycji.
Przebieg biopsji IB
Standard, według którego w naszej pracowni przebiega każda procedura IB wygląda następująco:
1. Rozmowa z pacjentem wyjaśniająca przebieg procedury (5–10 min).
2. Maksymalnie komfortowe ułożenie pacjenta i wypozycjonowanie robota z prowadnikiem do igły
biopsyjnej w odbytnicy (do 10 min) (ryc. 2).
3. Wykonanie sekwencji służących do zlokalizowania obszarów restrykcji dyfuzji i zaplanowania miejsca
biopsji (do 10 min) (ryc. 3).
4. Biopsja z pobraniem materiału z 1–2–3 ognisk (do 10 min).
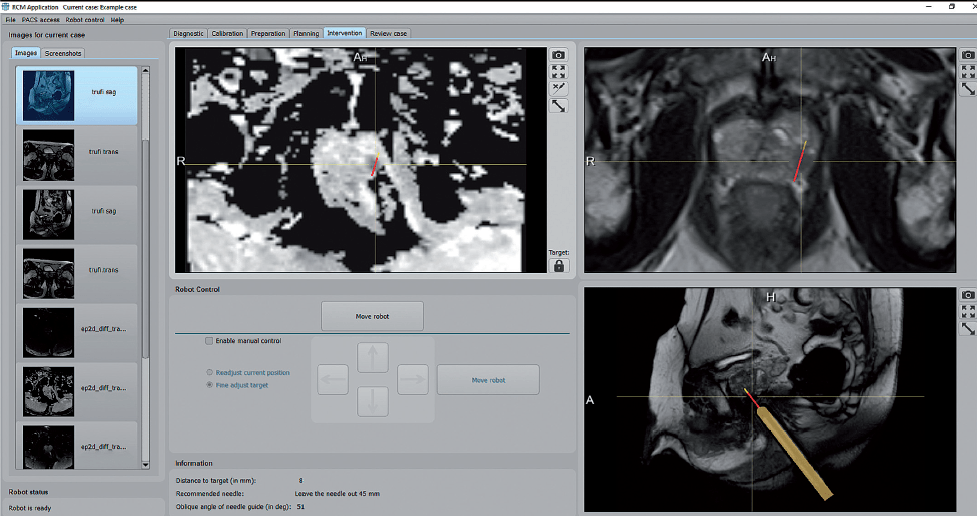
Ryc. 2. Określenie położenia manipulatora robota i jego synchronizacja z obrazami odpowiedniego obszaru anatomicznego ciała pacjenta. Strzałka wskazuje rzeczywiste położenie manipulatora w odbytnicy, zsynchronizowanego z oprogramowaniem robota (żółty kontur)
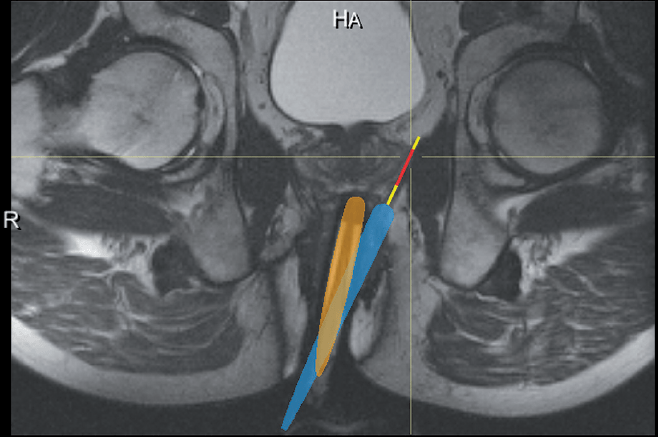
Ryc. 3. Planowanie odpowiedniego ukierunkowania manipulatora w stosunku do przewidzianej do biopsji zmiany oraz określenie najtrafniejszej trajektorii igły biopsyjnej. Kontur żółty – rzeczywiste
aktualne położenie manipulatora, kontur niebieski – planowane docelowe położenie manipulatora, odcinek czerwony – planowana pozycja okienka do pobrania materiału przez igłę biopsyjną
Przed pobraniem każdego kolejnego wycinka podczas procedury wykonywane są szybkie sekwencje T2 weryfikujące pozycję manipulatora i potwierdzające jego poprawne ustawienie względem zmiany przewidzianej do biopsji.
Przygotowanie do biopsji IB nie różni się od przygotowania do standardowej biopsji przezodbytniczej.
Jeśli chodzi o dolegliwości bólowe w przypadku biopsji IB, nasi pacjenci stwierdzali, że były znacznie mniejsze niż podczas TRUS, a poziom bólu w skali od 1 do 10 określali jako 1–2.
Przypadek 1
Pacjent lat 58 po 5 ujemnych biopsjach – 1 fuzyjnej przezkroczowej USG/MR, 4 saturacyjnych TRUS przezodbytniczych. Narastanie PSA, obecnie 28 ng/ml.
W badaniu DRE bez zmian. W badaniu MR przed biopsją fuzyjną w 2020 roku potwierdzona zmiana PI–RADS 4 w przedniej strefie płata lewego, o wymiarach 13 x 8 mm (ryc. 4). W badaniu MR przed biopsją in-bore widoczna progresja zmiany do PI-RADS 5 (15x 9 mm).
Pobrano 3 wycinki:
A – część centralna zmiany: Gl.s. 4+3; (grade group 3); 40% utkania nowotworu.
B – część wierzchołkowa zmiany: Gl.s. 4+3 z dodatkową komponentą 5; (grade group 3); 55% odsetek utkania nowotworu.
C – część podstawna zmiany: Gl.s. 4+3 z dodatkową komponentą 5; (grade group 3); 80% utkania nowotworu.
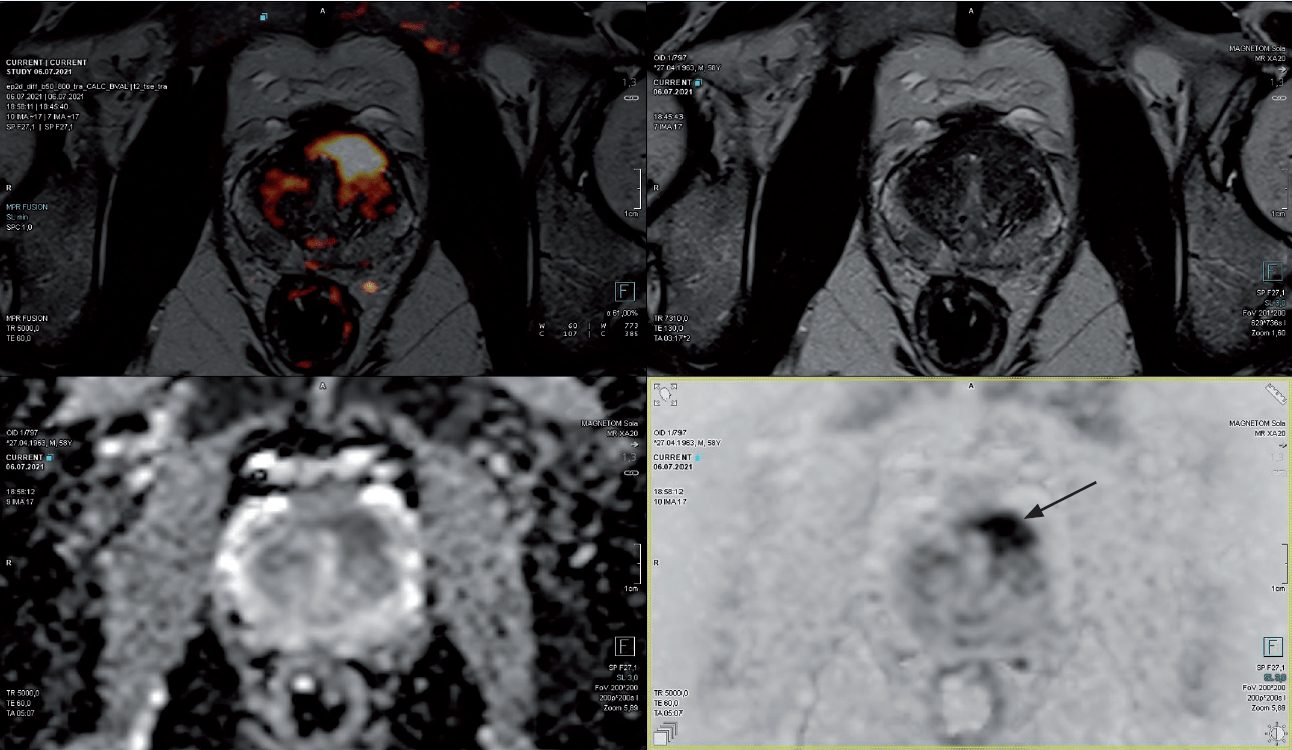
Ryc. 4. Zmiana PI-RADS 5 w przedniej strefie płata lewego (strzałka) w obrazach T2, DWI, ADC oraz fuzji obrazów T2 i DWI
Przypadek 2
Pacjent lat 74 w aktywnym nadzorze po wykonanej biopsji saturacyjnej z wynikiem Gl.s. 3+3. W badaniu MR w 2019 roku uwidoczniona zmiana w przedniej strefie płata prawego, o charakterze PI-RADS 4 (9 x 7 mm). Biopsja fuzyjna USG/MR wykonana po badaniu MR ujemna. Narastanie PSA, obecnie 8,24 ng/ml. W badaniu DRE stercz niebolesny, o wzmożonej spoistości. W badaniu MR przed biopsją in-bore widoczna progresja zmiany PI-RADS 4 (12 x 8 mm) (ryc. 5).
Pobrano 3 wycinki:
A – część centralna zmiany: Gl.s. 3+4; (grade group 2); 20% utkania nowotworu.
B – część przyśrodkowa zmiany: Gl.s. 3+4; (grade group 2); 30% utkania nowotworu.
C – część boczna zmiany: Gl.s.3+3; (grade group 1); 10% utkania nowotworu.
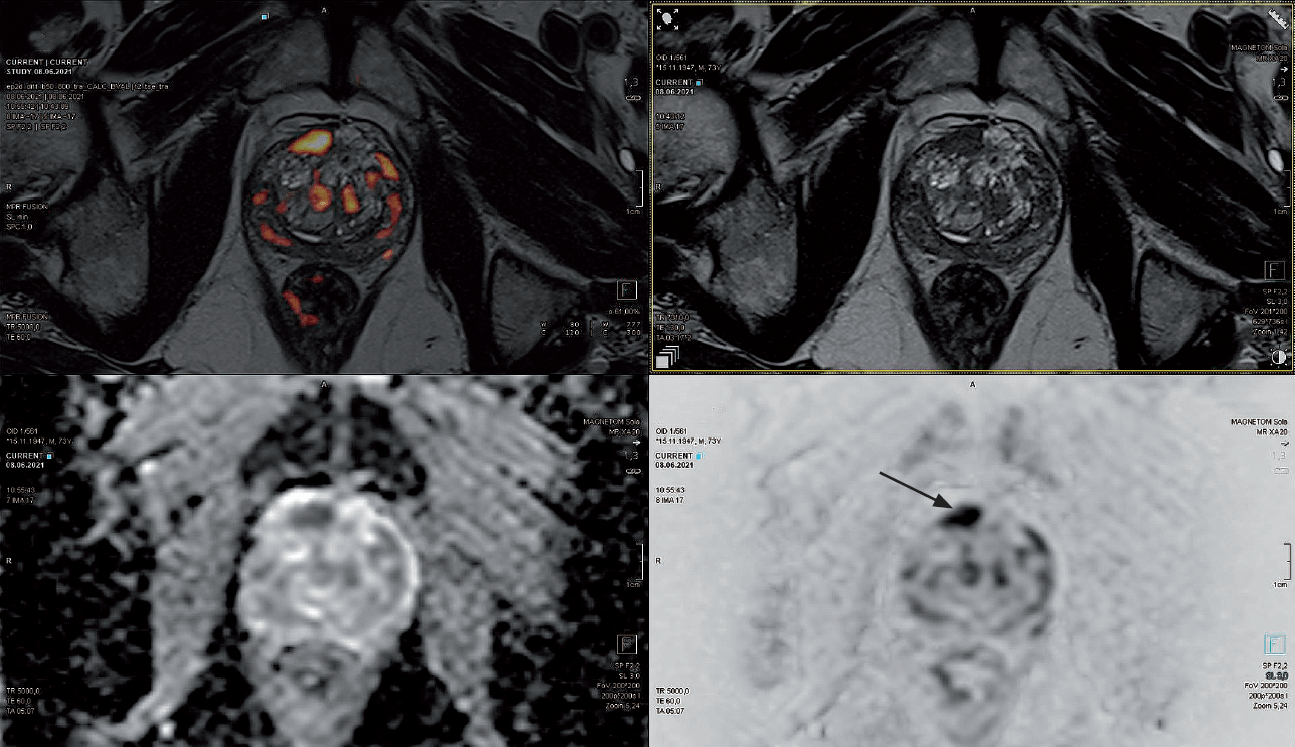
Ryc. 5. Zmiana PI-RADS 4 w przedniej strefie płata prawego (strzałka) w obrazach T2, DWI, ADC oraz fuzji obrazów T2 i DWI
Przypadek 3.
Pacjent lat 73 z narastającym stale PSA, obecnie 30 ng/ml. Od 2018 roku wykonano 5 biopsji saturacyjnych, z wynikiem ujemnym. W badaniu DRE stercz gładki, niebolesny, o prawidłowej spoistości. W badaniu MR wykonanym przed biopsją in-bore widoczna zmiana PI-RADS 5 w przedniej strefie płata prawego, o wymiarach 17 x 15 mm (ryc. 6).
Pobrano 3 wycinki:
A – część centralna zmiany: Gl.s. 4+3; (grade group 3); 60% utkania nowotworu.
B – część górna zmiany: Gl.s. 4+3; (grade group 3); 70% utkania nowotworu.
C – część dolna zmiany: Gl.s. 4+3; (grade group 3); 60% utkania nowotworu.
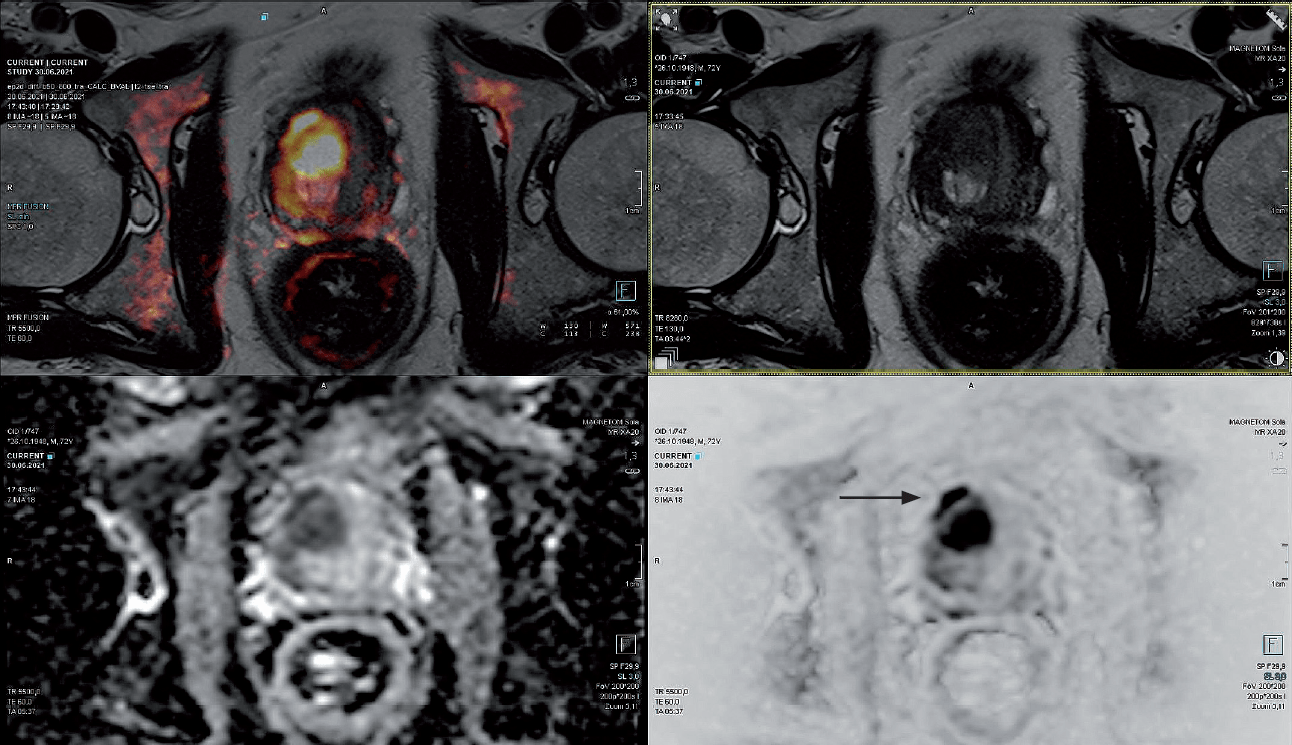
Ryc. 6. Zmiana PI-RADS 5 w przedniej strefie płata prawego (strzałka) w obrazach T2, DWI, ADC oraz fuzji obrazów T2 i DWI
Przypadek 4.
Pacjent lat 88 z licznymi chorobami współistniejącymi, z poziomem PSA 3,5 ng/ml. W badaniu DRE wyczuwalny drobny guzek w płacie lewym, z powodu którego pacjent został skierowany do pracowni MR. W badaniu MR uwidoczniono zmianę PI-RADS 4 (8 x 7 mm) w tylnej strefie płata lewego (ryc. 7). Ze względu na wiek pacjenta, obciążenie kliniczne schorzeniami internistycznymi oraz odmowę wykonania standardowej biopsji TRUS z pobraniem wielu wycinków pacjent zgodził się na procedurę in-bore z pobraniem materiału wyłącznie ze zmiany.
Pobrano 3 wycinki:
A – część centralna zmiany: Gl.s. 4+3; (grade group 3); 50% utkania nowotworu.
B – część przyśrodkowa zmiany: Gl.s. 4+3; (grade group 3); 40% utkania nowotworu.
C – część boczna zmiany: Gl.s. 4+4; (grade group 4); 70% utkania nowotworu.
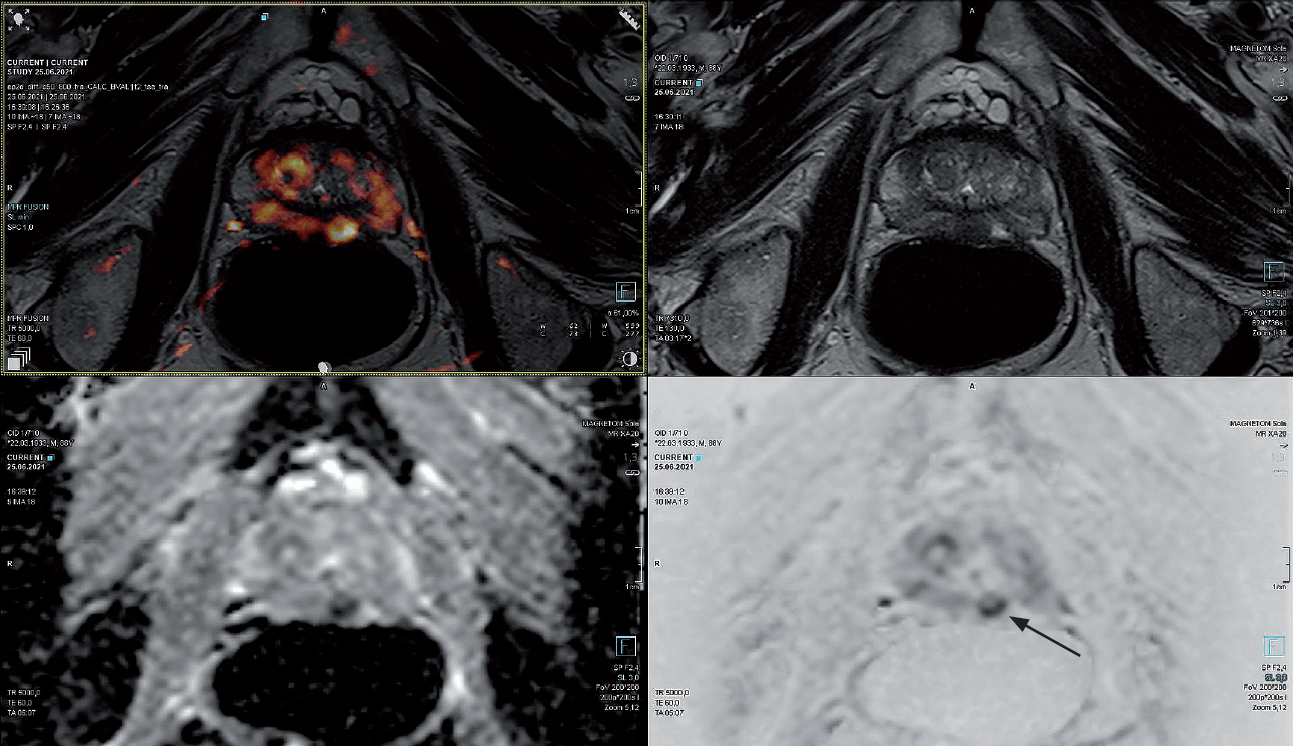
Ryc. 7. Zmiana PI-RADS 4 w tylnej strefie płata lewego (strzałka) w obrazach T2, DWI, ADC oraz fuzji obrazów T2 i DWI
Przypadek 5.
Pacjent lat 63 po przebytym zabiegu resekcji guza jelita grubego w marcu 2021 r., z poziomem PSA 16,35 ng/ml. W badaniu przezodbytniczym stercz gładki. W badaniu MR uwidoczniono niejednorodny obszar o charakterystyce sygnału PI-RADS 5 (18 x 12 mm) w tylnej strefie podstawy prawego płata, przylegający do pęcherzyków nasiennych (ryc. 8). Pacjent ze względu na niedawno przebyte leczenie onkologiczne z powodu wysokiego poziomu lęku poszukiwał metody diagnostycznej o jak najmniejszej inwazyjności przy jak najwyższej skuteczności. W rezultacie podjął decyzję o wykonaniu biopsji in-bore z pobraniem materiału wyłącznie ze zmiany.
Pobrano 5 wycinków:
A – część centralna zmiany: Gl.s. 4+3; (grade group 3); 80% utkania nowotworu.
B – część wierzchołkowa zmiany: Gl.s. 4+5; (grade group 5); 60% utkania nowotworu.
C – część podstawna zmiany: Gl.s. 4+3; (grade group 3); 75% utkania nowotworu.
D – część przyśrodkowa zmiany: Gl.s. 4+3; (grade group 3); 85% utkania nowotworu.
E – część boczna zmiany: Gl.s. 4+4; (grade group 4); 70% utkania nowotworu.
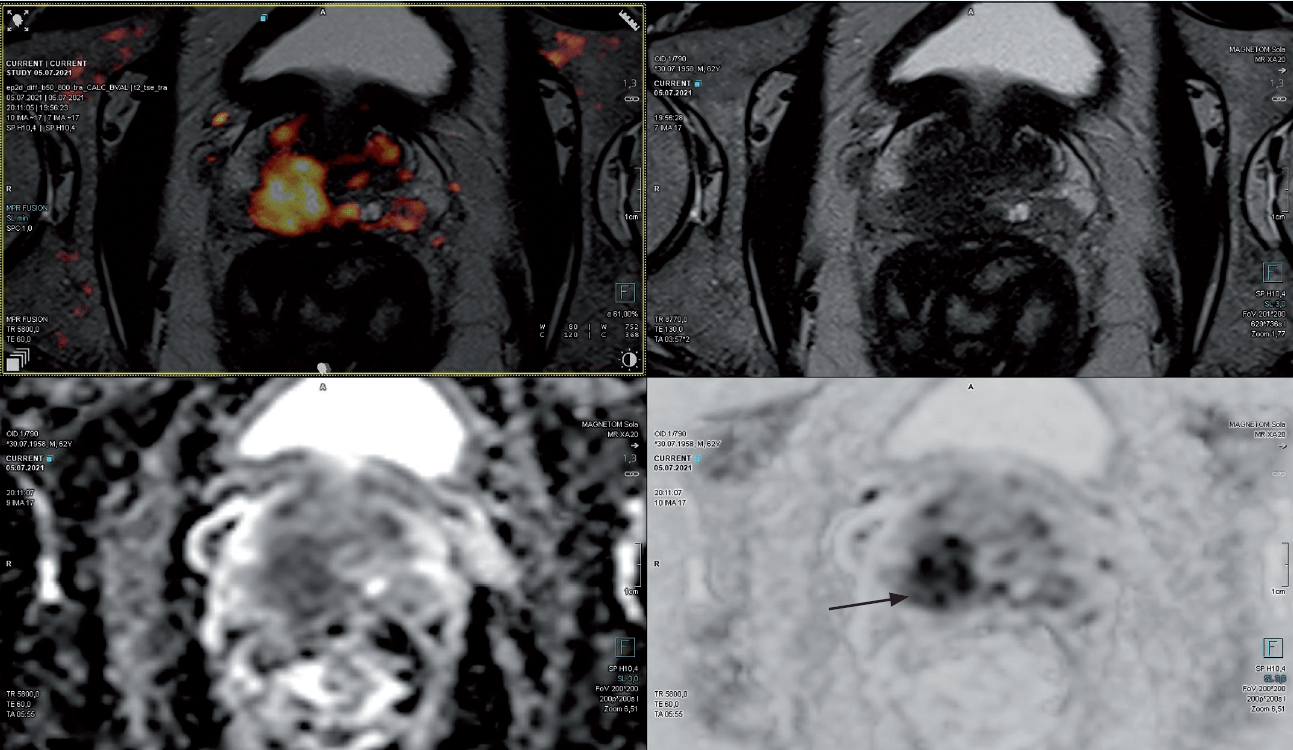
Ryc. 8. Obszar o charakterystyce sygnału PI-RADS 5 (18 x 12 mm) w tylnej strefie podstawy prawego płata (strzałka), przylegający do pęcherzyków nasiennych
Podsumowanie
- Skuteczność biopsji in-bore w dużej mierze zależy od stopnia wyjaśnienia pacjentowi, na czym polega procedura i przygotowania go do badania.
- W placówkach referencyjnych, specjalizujących się w urologii, czas trwania całej procedury nie powinien przekroczyć 60 min, a w znaczącym odsetku pacjentów zamknąć się w czasie 30–45 minut.
- Współpraca radiologa z urologiem ma znaczący wpływ na skuteczność biopsji oraz na krótki czas jej trwania.
- Każda biopsja in-bore powinna być poprzedzona wysokiej jakości badaniem MR stercza. W pracowni Quadia wymagamy wykonania badania MR stercza u nas i na podstawie jego wyniku kwalifikujemy pacjentów do IB.
- Informacja zwrotna od pacjentów dotycząca komfortu i poziomu bólu w trakcie IB wydaje się bardzo optymistyczna – w skali od 1 do 10 żaden z pacjentów nie zgłosił poziomu bólu powyżej 2.,
dr n. med. Magdalena Zagrodzka
Quadia, Pracownia Rezonansu Magnetycznego, Piaseczno
lekarz Marek Zawadzki
Oddział Urologii, Szpital św. Anny w Piasecznie
lekarz Przemysław Zugaj
Oddział Urologii, Szpital św. Anny w Piasecznie
lekarz Mateusz Mokrzyś
Oddział Urologii, Szpital św. Anny w Piasecznie
lekarz Damian Sujecki
Oddział Urologii, Szpital św. Anny w Piasecznie
lekarz Grzegorz Gacki
Oddział Urologii, Szpital św. Anny w Piasecznie
lekarz Marcin Radko
URMED Medical Center, Warszawa
dr n. med. Wojciech Tur
UROMED GÓRCE, Warszawa
dr n. med. Mieszko Kozikowski
CMKP. Klinika Urologii, Centrum Medyczne Kształcenia Podyplomowego, Warszawa
dr n. med. Tomasz Piecha
Klinika Urologii Warszawskiego Uniwersytetu Medycznego
dr n. med. Michał Pyzlak
Centrum Diagnostyki Patomorfologicznej, Warszawa
dr n. med. Jacek Brzeziński
Quadia, Pracownia Rezonansu Magnetycznego, Piaseczno
technik elektroradiolog Patryk Sulmiński
Quadia, Piaseczno